痛风
| 痛风 | |
|---|---|
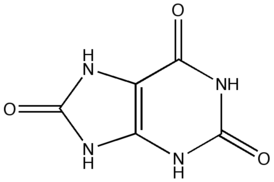 尿酸 | |
| ICD-10 | M 10. |
| ICD-10-公里 | 和 |
| ICD-9 | 274.0 274.1 274.8 274.9 |
| ICD-9-KM | ,,和 |
| OMIM | 138900 |
| 疾病数据库 | 29031 |
| Medlineplus | |
| 电子医学 | emerg / 221 med/924 med/1112 oph/506 orthoped/124 radio/313 |
| 网眼 | D006073 |
痛风(古希腊。 ποδάγρα,逐字- 陷阱腿 ;从πούς,属Ñ.. Ποδός - 英尺和ἄγρα - 渔猎)[3] - 代谢性疾病,其特征是在沉积在所述主体的晶体的各种组织尿酸盐的形式单尿酸钠或尿酸。发生基于尿酸的积累和肾脏排泄的减少,这导致血液中尿酸浓度的增加(高尿酸血症))临床上,痛风表现为复发性急性关节炎和痛风性结节- 豆腐的形成。肾脏损伤也是痛风和关节炎的主要临床表现之一。该疾病多发于男性,但最近该疾病在女性中的流行率在增加,随着年龄的增长,痛风的流行率也在增加。为了治疗,使用了影响疾病致病机理的药物以及对症治疗药物。
历史
自古以来就已知道痛风。该病的第一个文献证据可从古埃及得知,其历史可追溯到公元前2600年。e。[4]它们是基于对拇指痛风性关节炎的描述[4]。公元前五世纪的古希腊医士和希波克拉底医生。 e。在他的“警句”中描述了痛风性关节炎的临床症状,他指出该病直到更年期才在太监和女性身上发生[5] [6]。罗马哲学家和医师Aulus Cornelius Celsus描述了痛风的发展与饮酒和相关肾损害之间的关系[7]。在150年,盖伦(Galen)指出痛风是由“谨慎,大小便失禁和遗传”引起的[8]。
在17世纪末,英国临床医生Thomas Sydenham患有痛风超过30年将其归类为另一种疾病,并在他的《痛风病论文》中非常准确地描述了痛风性关节炎的急性发作的临床表现。 Tractatus de podagra et hydrope) 。在这篇文章中,他将痛风的疼痛综合症与“来自四肢压力的疼痛” 进行了比较,并描述了患者的感觉,这与“一只大狗用犬齿挖入手指”的感觉相当[9]。 1679年,荷兰科学家安东尼·范·莱文古克(Anthony van Levenguk)首先描述了尿酸晶体的微观结构[5]。
1848年,一位英国生理学家 阿尔弗雷德·巴林·加罗德(Alfred Baring Garrod)(1819-1906)在一根线压入痛风患者血液的过程中,发现并描述了增加其含量的事实。这种疾病的血液尿酸 [10] [11] [12 ] ]。
法国医生的第一项科学著作 让·马丁·夏科特(Jean Martin Charcot)提到了痛风领域:“痛风软骨的损害”(法国 Lesaltérationsdes软骨软骨,于1858年),“痛风外耳中的痛风沉积物(豆腐)”(Les contretionstophacéesde l'oreille externe chez les goutteux,1860年,“痛风引起的肾脏变化”(Lesaltérationsdu rein chez les goutteux,1864年),“关于痛风和铅中毒”(Les rapports de la goutte et de l'intoxication saturnine, 1864)。
1899年,在痛风性关节炎发作期间,发现关节液中存在尿酸盐晶体。1961年,MacCarty和Hollander揭示了尿酸盐晶体在痛风性发炎的发生和发展中的作用[13]。
历史上,从中世纪到20世纪,主要是富裕和贵族遭受痛风,与之相关的被称为“国王的疾病” [4])出版了名为“关于贵族痛风及其伴随的美德”的小册子。他称赞痛风,并指出这是国王,王子,杰出的军事领导人,有才华的人的病,并列举了患痛风的加冕者,政客和艺术家的例子[15]。在痛风感兴趣的新的爆发出现在二十世纪之初,当霭理士(工程,自然 [14],“富人的疾病”和“贵族的疾病” [4]。。据认为,这与超重,暴饮暴食(尤其是肉类滥用)和酒精饮料的过量消费有关。例如,在1739年,法国人尤金Mushron( FR。 尤金Moucheron Havelock Ellis,1859-1939)在1927年出版了一本名为《英国天才的历史》的书。在其中,作者讨论了痛风的话题,并以55名著名的受苦英国知名人士为例[16]。 1955年,工作埃贡·奥罗万,人类的起源,发表在杂志”中,他描述了天才中痛风感染的发生率增加,并解释说尿酸在结构上与甲基化嘌呤非常相似:和可可碱咖啡因,茶碱,它们是精神活动的刺激物,对脑高级功能有刺激作用,特别是,注意力跨度和专注力。 Orovan指出,除了人类和类人猿以外,所有发达哺乳动物的尿酸都通过肝脏产生的尿酸酶分解为尿囊素的作用而分解。在灵长类动物中,由于缺乏尿酸酶,它仍然存在于血液中[16]
流行病学
高尿酸血症在4-12%的人群中检测到,0.1%的俄罗斯人群患有痛风[17]。在美国和欧洲,2%的人患有痛风;在55-65岁的男性中,4-6%的人患有痛风。
男女比例为7:1至19:1。高峰发生在男性40-50岁,女性60岁以上。绝经前女性很少生病,可能是由于暴露雌激素对尿酸排泄的影响[17]。
在不同人群中,痛风性关节炎的发生频率为每千名男性5至50人,每千名女性1至9人,每年新发病例为每千名男性1-3人,每千名女性0.2人[17]。。在过去十年中[ 什么时候?]痛风发生率增加了 [18]。
很少观察到青少年和年轻人对痛风的急性发作,通常是由尿酸合成中的主要或次要缺陷引起的 [17]。
病因
疾病发展的因素
在某些个体中,有许多风险因素会导致痛风的发生和发展。
痛风的危险因素包括动脉高血压,高脂血症和:
- 嘌呤碱的摄入量增加,例如,当食用大量的红肉(尤其是内脏),某些种类的鱼,可可,茶,巧克力,豌豆,小扁豆,果糖,酒精(尤其是含有大量鸟苷和黄嘌呤)是尿酸的前体);
- 具有一般分解代谢(例如,抗肿瘤治疗;大量)的嘌呤核苷酸数目增加 自身免疫性疾病凋亡);
- 抑制尿中尿酸排泄(例如,肾功能衰竭);
- 增加尿酸的合成,同时减少其从体内的排泄(例如,酗酒,休克,糖原异生)异症和葡萄糖-6-磷酸酶缺乏症);
- 遗传倾向(遗传的性质仍未完全阐明)。
发病机制
该疾病的发病机理是基于血液中尿酸水平的升高。但是,由于高尿酸血症,这种症状并非疾病的代名词还会与其他疾病(血液疾病,肿瘤,肾脏疾病等),极高的身体负担和食用高脂食物一起观察到。
痛风的发生至少有三个主要因素:
- 体内尿酸化合物的积累;
- 这些化合物在器官和组织中的沉积;
- 在这些病变中发炎的急性发作发展,形成痛风性肉芽肿和痛风“圆锥”-豆腐,通常在关节周围。
这种疾病的症状,当然
痛风的完全自然演变经历四个阶段:
- 无症状的高尿酸血症;
- 急性痛风性关节炎 ;
- 临界期
- 关节中的慢性痛风沉积。
肾结石可以在除第一阶段的任何阶段发展。血浆和尿液中尿酸的浓度不断增加;单关节炎的关节发炎,伴有剧烈的疼痛和发烧;尿石症和复发性肾盂肾炎,导致肾硬化和肾衰竭。
诊断
痛风性关节炎的诊断可以在第三国际研讨会上风湿性疾病的研究,采用流行病学诊断标准的基础上进行的纽约,1966年。
1.用化学或显微镜方法检测滑液中尿酸晶体或组织中尿酸盐的沉积。
2.如果有两个或多个这些条件:
- 明确的病史和/或观察到至少有四次四肢关节肿痛发作(至少在早期阶段,发作应始于严重的疼痛综合征;应在1-2周内完全缓解));
- 清楚的历史和/或观察到痛风发作(见上文)且脚趾受损;
- 临床证明的豆腐;明确的病史和/或观察到的秋水仙碱快速反应,即开始治疗后48小时内炎症的客观体征减少。
X射线研究未包括在必需的诊断检查清单中,但可能显示豆腐的晶体沉积和由于反复发炎而对骨组织造成的损害。X射线还可用于监测慢性痛风对关节的影响。
检测高尿酸血症不足以建立诊断,因为只有10%的高尿酸血症患者患有痛风[17]。
痛风诊断标准(WHO 2000)
I.关节液中特征性尿酸盐的存在。
二。含有结晶尿酸盐的豆腐(经证实)的存在,已通过化学方法或偏光显微镜确认。
三,以下12个标志中至少有6个存在:
- 不止一种急性关节炎发作史;
- 第一天关节最大发炎;
- 关节炎的单关节性质;
- 患处关节皮肤充血;
- meta趾关节局部肿胀或疼痛;
- 对足弓关节的单方面损害;
- 豆腐状结节 ;
- 高尿酸血症
- meta趾关节的单侧病变;
- 受影响关节的不对称肿胀;
- 皮层下囊肿的X线片检查无侵蚀;
- 关节液中缺乏菌群。
最可靠的体征是急性或较不常见的亚急性关节炎,滑液中结晶尿酸盐的检测以及已证实的豆腐的存在。尿酸盐晶体看起来像棍棒或细针,其末端折断或倒圆,长约10微米。的微晶尿酸盐在滑液中发现两个自由躺在和嗜中性粒细胞。
鉴别诊断
痛风以败血症为特征,可以与脓毒症同时发生,也可以与其他微晶性关节炎(与晶体相关的滑膜炎,主要与软骨钙化病(主要与焦磷酸钙沉积 -特别是老年人)有关; 反应性,银屑病和类风湿性关节炎。
治疗
首先检测到痛风的患者或在疾病加重期间,要在区域或城市医院的专业风湿病科接受住院治疗。在疾病缓解期间有痛风的患者,只要开出足够的治疗方法,可以在风湿病医生,肾脏病医生的指导下进行在地区诊所的居住地。在平稳情况下(专业风湿病科)的大概治疗时间为7-14天,但要选择适当的有效治疗方法,并改善疾病的临床和实验室症状。
迄今为止,现代药理学还不能同时提供一种通用的药物,并且可以真正解决痛风的问题。
痛风的治疗包括:
- 如果可能,迅速而谨慎地缓解急性发作;
- 预防急性痛风性关节炎的复发;
- 预防或消退由单取代尿酸钠晶体在关节,肾脏和其他组织中沉积引起的疾病并发症;
- 预防或消退肥胖,高甘油三酯血症或高血压等伴随症状;
- 预防尿酸肾结石的形成。
治疗痛风的急性发作
在急性痛风性关节炎中,进行抗炎治疗。最常用的秋水仙碱。处方为口服,通常以每小时0.5 mg或每2小时1 mg的剂量服用,并持续治疗直至:1)减轻患者的病情; 2)胃肠道无不良反应,或3)在无效果的情况下,药物的总剂量不会达到6 mg。如果症状发作后不久开始治疗,秋水仙碱最有效。在治疗的前12小时中,超过75%的患者的病情明显改善。但是,在80%的患者中,该药物会引起胃肠道不良反应,这种不良反应可能较早发生或与临床改善同时发生。摄入时,约2小时后血浆中秋水仙碱达到最高水平,因此,我们可以假定其摄入量为1,每2小时0 mg不太可能引起毒性剂量的累积,直到产生治疗效果为止。但是,由于治疗效果与白细胞而非血浆中秋水仙碱的水平有关,因此治疗方案的有效性需要进一步评估。
通过静脉注射秋水仙碱,不会出现胃肠道的副作用,并且患者的病情会更快好转。单次注射后,白细胞中的药物水平升高,在24小时内保持不变,甚至可以在10天后确定。作为初始剂量,应静脉内注射2 mg,然后,如有必要,以6小时为间隔重复两次1 mg的给药,秋水仙碱的给药应采取特殊的预防措施。它具有刺激性,如果进入周围组织,可能会导致严重的疼痛和坏死。。重要的是要记住,静脉内给药需要准确,药物应在5-10体积的生理盐水中稀释,并且输注应持续至少5分钟。秋水仙碱通过口服和肠胃外给药均可抑制骨髓功能并引起脱发,肝细胞衰竭,精神抑郁,抽搐,升麻痹,呼吸抑制和死亡。具有肝脏,骨髓或肾脏病理学的患者以及接受维持剂量秋水仙碱的患者更有可能产生毒性作用。在所有情况下,应减少剂量。中性粒细胞减少症患者不宜开处方。
在急性痛风性关节炎,其他抗炎药也是有效的,包括吲哚美辛,保泰松,萘普生,艾托考昔等。
消炎痛可按75 mg的剂量口服,此后每6个小时患者应服用50 mg;在症状消失后的第二天继续使用这些剂量进行治疗,然后将剂量降低为每8小时50毫克(3次)和每8小时25毫克(也是3次)。消炎痛的副作用包括胃肠道不适,钠retention留和中枢神经系统症状。尽管事实上这些剂量可在近60%的患者中引起副作用,但消炎痛通常比秋水仙碱更容易耐受,可能是急性痛风性关节炎的首选治疗方法。尿酸排泄药物和别嘌醇急性发作时,痛风无效。在急性痛风中,特别是秋水仙碱和非甾体类抗炎药的禁忌症或无效药,全身或局部(即关节内)给予糖皮质激素是有益的。对于全身给药,无论是口服还是静脉给药,都应开几天服用中度剂量,因为糖皮质激素的浓度会迅速下降并且其作用会停止。关节内长效类固醇药物(例如曲安奈德 曲安奈德的剂量为15-30 mg)可以在24-36小时内停止单关节炎或滑囊炎的发作,如果您不能使用标准剂量方案,这种治疗尤其可取。
饮食
传统的饮食指南是限制您摄入嘌呤和酒精。高嘌呤食物包括肉和鱼产品,以及茶,可可和咖啡。最近,还显示出适度限制碳水化合物和高热量食物实现的减肥,以及痛风患者中蛋白质和不饱和脂肪酸的比例增加,导致尿酸水平和血脂异常的明显减少[19]。
另请参阅
- 微晶性关节炎
- 软骨钙化病
- 浦田
- 尿酸
- 豆腐
注释
- ↑ 回去: 1 2 3 4 Monarch Disease Ontology版本2018-06-29sonu-2018-06-29-2018。
- ↑ 回去: 1 2 3 4 疾病本体发布2019-05-13-2019-05-13-2019。
- ^ 痛风 / V.G.巴尔斯科夫//秘鲁-半挂车。- 中号 :俄罗斯大百科全书,2014年- P. 524 - (俄罗斯大百科全书 :[在35个体积] /通道版。于S.奥西波夫。 ; 2004至2017年,第26卷)。- ISBN 978-5-85270-363-7。
- ↑ 回去: 1 2 3 4 Richette P.,Bardin T.Gout //柳叶刀。-2010年1月。-卷。375,第9711号。-第318至328页。-DOI:10.1016 / S0140-6736(09)60883-7。-PMID 19692116。
- ↑ 回去: 1 2 Pillinger MH,Rosenthal P.,Abeles AM 高尿酸血症和痛风:发病机理和治疗的新见解 //纽约大学联合疾病医院简报。-2007年-卷。65号3号。-第215–221页。-PMID 17922673。归档于2008年 12月16日。
- ^ 互联网经典由希波克拉底存档格言。麻省理工学院。
- ^ A. Cornelius Celsus。 论医学。芝加哥大学。
- ^ Zilva J. F.,Pannell P. R.临床化学在诊断和治疗中。- 中号:医学,1988 .-- 528页。- ISBN 5-225-00220-X。
- ^ Nasonova V.,Barskova V.疾病丰富// 科学与生活。-2004年- 第7号。
- ↑ Garrod AB痛风和风湿性痛风的性质和治疗。-伦敦:沃尔顿和马伯利(1859年)。
- ^ Keitel W.痛风大祭司-Alfred Baring Garrod爵士(1819–1907)// Z Rheumatol。-2009年-卷。68,第10号。-第851-856页。- DOI:10.1007 / s00393-009-0541-4。- PMID 19937040。
- ^ 楼层GD阿尔弗雷德·巴林·加罗德(1819–1907)//风湿病学(牛津大学)。-2001年-卷。40,第10号。-第1189-1190页。- DOI:10.1093 /风湿科/ 40.10.1189。- PMID 11600751。
- ↑ McCarthy DJ,Hollander JL痛风性滑液中尿酸盐晶体的鉴定。// 内科医学年鉴。-1961年-卷。54.-第452页。
- ^ 国王疾病-Forbes.com。福布斯。
- ^ Zaselsky V.,Lalayants I.天才的本质// Spark。-1996年- 第27号。- S. 4。
- ↑ 回去: 1 2 Lalayants I. 尿酸击中头部。天才的锥体不应该放在头上,而应该放在腿上 //在世界各地。-2008年。
- ↑ 回去: 1 2 3 4 5 版 S.L. 纳索诺娃。临床建议。风湿病学。-GEOTAR-Media,2008年。-第112-119页。-288羽 -ISBN 978-5-9704-0698-4。
- ^ 丽莎·K·斯坦普(Lisa K.Stamp),托尼·R·默里曼(Tony R. 痛风 (英语) //柳叶刀。-2016-10-22。- T. 388,没有。10055。- S.二〇三九年至2052年。- ISSN 1474-547X 0140-6736,1474-547X。- DOI:10.1016 / S0140-6736(16)00346-9。
- ↑ 巴尔斯科娃,V.G. &V.A. Nasonova (2002),痛风和胰岛素, <http://medinfa.ru/article/31/117288/>抵抗综合症,于 2009年2月1日存档在Wayback Machine上
链接
- 尿酸击中您的头 //世界各地
More posts:
All Posts